Les métaux¶
Ce texte est paru sous une version modifiée dans La Recherche, Novembre 2005 dans la rubrique Bac To Basics
C’est nickel, y croire dur comme fer, un soleil de plomb, ça vaut de l’or, gagner de l’argent, avoir un moral d’acier… autant d’expressions qui témoignent de la présence massive des métaux dans notre vie quotidienne. Leurs productions se chiffrent aujourd’hui en millions de tonnes, pourtant que connaît-on des propriétés singulières de ces matériaux ?
Depuis quand sait on travailler les métaux ?¶
Les premiers métaux connus de l’homme furent l’or, l’argent et le cuivre car ils se trouvaient en tant que tel à l’état naturel. Etant trop mous pour servir d’armes, leur usage restait décoratif (bijoux, ornements). On peut penser que les véritables premières traces de la métallurgie correspondent à l’utilisation du bronze obtenu simplement en chauffant quelques pierres à haute température il y a plus de 5000 ans au moyen orient. On comprend ensuite que les métaux peuvent être fondus, éventuellement mélangés en proportion adéquate, moulés et travaillés pour obtenir des objets de formes variées et plus résistants que les métaux naturels. Pendant plus de deux millénaires, le bronze, alliage de cuivre et d’étain, restera dominant car le fer nécessite d’être fondu à plus haute température et travaillé plus longtemps pour être de bonne qualité. Ce n’est que vers -1200 av J. C. que l’on découvre en Anatolie que le fer chauffé avec du charbon de bois et martelé est plus dur que le bronze. La maîtrise et la diffusion des techniques de métallurgie du fer marquent un tournant dans l’histoire des sociétés par son retentissement dans l’utilisation d’outils agricoles et d’armes plus efficaces. Beaucoup plus tard au 19ème siècle, de nouveaux métaux comme l’aluminium sont isolés grâce à la découverte de l’électrolyse. De nombreux progrès en sidérurgie font également du 19ème siècle « l’âge d’or » des aciers (alliages essentiellement à base de fer et de carbone) et sont au cœur de la révolution industrielle.
Sous quelle forme trouve t’on les métaux ?¶
Bien que le fer et le nickel se trouvent en abondance dans le noyau terrestre, la plupart des métaux accessibles (c'est-à-dire dans l’écorce terrestre) se présentent sous une forme d’oxyde ou de sulfure dans des minerais et non à l’état pur. La bauxite et l’hématite sont des exemples de minerais riches en oxyde d’aluminium (alumine) et en oxyde ferrique. A l’inverse, l’or est un métal pur à l’état naturel que l’on extrait facilement des roches ou alluvions aurifères. Si l’or est pur et inaltérable à l’air ambiant, c’est parce qu’il n’a aucune affinité avec l’oxygène contrairement à la plupart des métaux qui se corrodent facilement. Avec l’argent et le platine, il est l’un des rares métaux purs (et donc précieux), ce qui lui vaut le qualificatif de métal noble. Tout le monde sait par exemple que le fer rouille à l’air en formant une couche d’oxyde de fer. Les feuilles de cuivre qui recouvrent la statue de la Liberté n’échappent pas eux non plus à la « patine » du temps. Une couche d’hydrocarbonate de cuivre appelée vert-de-gris se forme alors sous l’action du gaz carbonique atmosphérique, ce qui lui donne cette teinte verte caractéristique. De nombreux métaux comme le zinc, l’aluminium ou l’étain sont protégés naturellement par la formation d’une fine couche d’oxyde en surface, appelée couche de passivation. La galvanisation et plus généralement les techniques dites de passivation, consiste en un dépôt de zinc à la surface d’une pièce métallique à protéger. Quant au fer blanc, il doit son nom à la couleur de la couche protectrice d’étain qui le recouvre.
Comment extrait t’on les métaux de leurs minerais ?¶
La rupture de la liaison forte métal-oxygène, appelée réduction constitue l’étape principale de l’extraction d’un métal. Pour le fer, le cuivre, le plomb ou le zinc, cette étape peut être réalisée par voie chimique sous l’action du monoxyde de carbone dégagé par la combustion de charbon appelé coke dans un haut fourneau. Les métaux obtenus ainsi sont riches en impuretés carbonées et doivent donc être purifiés. Dans le cas du fer, l’étape de réduction donne ce que l’on appelle la fonte et l’élimination des impuretés de celle-ci conduit à des aciers dans lesquels le taux de carbone n’excède pas 1,5%. Pour d’autres oxydes, le passage d’un courant électrique intense est nécessaire pour séparer le métal et l’oxygène. Ainsi l’électrolyse de l’alumine fondue à haute température produit de l’aluminium.
Quelle est la structure atomique d’un métal ?¶
Hormis le mercure, métal liquide à température et pression ambiantes, les métaux sont dans ces conditions des solides dits cristallins : ils se distinguent du verre (que l’on qualifie parfois abusivement de « cristallin ») par un arrangement ordonné (périodique) des atomes qui le composent. Une pièce métallique est ainsi constituée d’une multitude de petits cristaux (appelés « grains ») collés les uns aux autres et dont la taille va du nanomètre au centimètre. Par exemple, on peut facilement observer les larges grains de zinc qui recouvrent les pylônes électriques car ils offrent chacun à la lumière des reflets différents de leurs voisins, et forment ainsi une mosaïque de gris. Dans une description élémentaire plutôt adaptée aux métaux, les atomes peuvent être assimilées à des sphères dures en contact les unes avec les autres. La structure d’un grain cristallin se conçoit alors comme un empilement compact de couches d’atomes les unes sur les autres, un peu à la manière dont on chercherait à empiler des oranges en tas (figure 1).
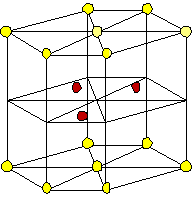
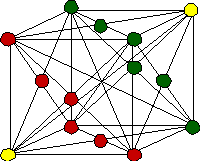
Figure 1: Les deux structures cristallines les plus compactes forment un réseau à 3 dimensions dont l'élément de base est une brique cubique décorée par des atomes sur les sommets et les faces du cube (structure cubique faces-centrées) ou hexagonale (décorée par des atomes sur les sommets, au centre des faces hexagonales et à l'intérieure). De façon alternative, on peut les voir comme étant des empilements de couches d'atomes (les atomes de même couleur forment une seule et même couche).
Le fait que les atomes interagissent également les uns avec les autres de façon collective conduit à la formation d’empilements différents en fonction de la nature des atomes. Ces empilements peuvent être décrits alternativement comme un assemblage périodique de briques élémentaires dans les trois directions de l’espace. Lorsque l’empilement des atomes est compact (c'est-à-dire contenant le maximum d’atomes par unité de volume), on obtient les structures des métaux les plus courants appelées cubique faces centrées (aluminium, cuivre, plomb…) et hexagonale compacte (zinc, titane…) par référence à la forme de la brique élémentaire. Il existe d’autres structures moins compactes comme la structure cubique centrée (brique cubique avec un atome au centre du cube : chrome, tungstène…) ou cubique simple (brique cubique sans aucun autre atome que sur les sommets : manganèse, uranium).
Pourquoi sont-ils aussi froids et brillants ?¶
Ces deux propriétés évoquent parfaitement l’état métallique commun à plus de la moitié des éléments chimiques répertoriés . Dans un métal, les atomes ont tendance à mettre leurs électrons périphériques en commun. Un métal peut ainsi être vu comme un réseau d’ions positifs baignant dans une « mer » d’électrons presque libres. Sous l’action d’une tension ou d’une différence de température, ces électrons périphériques peuvent facilement « sauter » d’un atome de proche en proche et créer un courant électrique ou un flux de chaleur. Ceci explique à la fois la très bonne conductivité électrique et thermique des métaux. La sensation de froid au contact d’une pièce métallique résulte de cette facilité à propager la chaleur de notre corps vers une partie plus froide du métal. Ces électrons périphériques dits de conduction étant plus libres peuvent facilement osciller sous l’influence d’une onde électromagnétique incidente (lumière visible, rayonnement infra-rouge, onde radio…) et deviennent alors à leur tour, émetteur. Ils absorbent et réémettent ainsi le rayonnement incident. C’est pour cette raison que les métaux brillent. Déposés en couches sur du verre, l’aluminium et l’étain sont pour cette raison d’excellents miroirs. En réfléchissant plus de 90% du rayonnement infrarouge, l’aluminium agit comme une véritable barrière thermique (tenues métallisées des volcanologues, couverture de survie…).
Est-il possible d’associer des atomes métalliques différents ?¶
Oui et on obtient des alliages dont les propriétés physiques peuvent être tout à fait différentes de celles des métaux purs qui les constituent. Ainsi, le bronze, alliage de cuivre et d’étain est plus dur que le cuivre et l’étain pris séparément. Certains alliages appelés quasi-cristaux qui ont une structure ordonnée mais non périodique sont de parfaits isolants ! En général, lorsqu’on mélange deux métaux, il se passe la même chose qu’avec l’huile et le vinaigre : les composés ne sont pas miscibles, et on obtient des phases distinctes. Ainsi, de la même manière que l’on assiste à la précipitation du sel dans une eau saumâtre, on peut observer à partir d’une certaine concentration et à une certaine température la coalescence de précipités de cuivre dans une matrice d’aluminium, comme dans le cas de l’alliage connu du Duralumin. Par contre, on comprend aisément que généralement en remplaçant un atome métallique par un autre de même taille, on pourra former un alliage stable: on parle alors de solution solide par substitution. Ainsi, dans l’alliage d’or et de cuivre 18 carats (Au_3Cu) de structure cubique faces centrées, les atomes de cuivre remplacent les atomes d’or normalement placés sur les sommets du cube. Une autre façon consiste à insérer des atomes plus petits dans les espaces laissés vacants dans la structure de la matrice. C’est ainsi que l’on peut dissoudre du carbone dans du fer. Par exemple dans les aciers austénitiques riches en carbone, les atomes de carbone se placent sur le milieu des arrêtes du cube de la structure cubique faces centrées du fer.
Pourquoi les métaux sont résistants à la cassure ?¶
Quiconque a laissé tomber un verre et une petite cuillère sait que ces deux matériaux se comportent totalement différemment. Le premier se brise brutalement alors que le second « absorbe » le choc. La différence fondamentale dans ces deux comportements tient au fait que les métaux peuvent se déformer de manière irréversible (on dit qu’ils sont plastiques) en dissipant l’énergie grâce à des défauts appelés dislocations. On peut les imaginer si on effectue la construction suivante: prenez un cristal parfait et créer une entaille en coupant les liaisons séparant deux couches d'atomes. Ecartez maintenant l'entaille, et ajoutez des atomes pour boucher le trou. Recollez le tout et faites relaxer les contraintes résiduelles. Le long de l'entaille, les liaisons se recollent plutôt bien mais lorsqu'on approche vers le fond de l'entaille, les liaisons sont de plus en plus fortement distordues. L'endroit où l'entaille s'arrête (une ligne) correspond au coeur de la dislocation (figure 2). On peut la voir également comme étant un cisaillement de la partie supérieure du cristal (au dessus de l'entaille) par rapport à la partie inférieure (sous l'entaille).
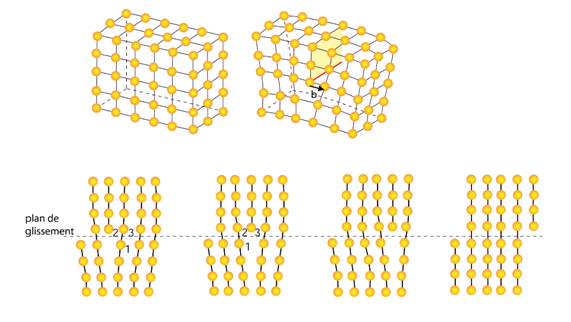
Figure 2: Une dislocation peut être imaginée comme étant la ligne qui délimiterait l'arrête d'un coin enfoncé dans la structure parfaite. La dislocation est le moyen le plus économique de cisailler un cristal. Elle procède en se déplaçant de proche en proche en coupant et recollant une liaison sur son passage, à la manière d'une double fermeture-éclair.
En créant et déplaçant les dislocations dans l’ensemble du cristal, on propage la déformation à moindre coût simplement en coupant et recollant de proche en proche les liaisons atomiques. On préserve ainsi la cohérence du matériau. Le verre qui a une structure désordonnée est extrêmement fragile car la notion même de dislocation n’existe pas. La cassure intervient par la rupture de toutes les liaisons atomiques le long d’une fissure comme une fermeture éclair. Les mêmes mécanismes peuvent être invoquées pour expliquer la malléabilité des métaux. Dans les métaux mous (or, cuivre…), les liaisons atomiques sont faibles, et il est facile de créer un grand nombre de dislocations mobiles. Dans les cristaux fragiles, où les liaisons sont fortes, il est impossible de créer et/ou déplacer des dislocations . Toutefois, il est possible de déformer ce type de matériau si on apporte un surplus d’énergie sous la forme d’agitation thermique. De manière plus générale, les propriétés mécaniques des métaux sont influencées par la température. Ainsi, leur ductilité augmente avec la température. C’est pour cette raison qu’il est plus facile de les mettre en forme à haute température. A l’inverse, il existe une température critique en dessous de laquelle le mouvement des dislocations est « gelé ». C’est pourquoi les Liberty Ships américains de la première guerre mondiale, dont la coque était en acier ordinaire se brisèrent dans les eaux froides de l’arctique.
Comment obtient on des métaux durs et résistants ?¶
Si la plupart des métaux purs ont un usage limité du fait de leur trop grande ductilité, ils peuvent être notablement durcis. On comprend intuitivement que le durcissement d’un métal résulte d’une réduction de la mobilité des dislocations. Il existe de nombreux types d’obstacles, à commencer par les dislocations elles mêmes qui peuvent s’enchevêtrer lors de leur mouvement. En simplifiant, plus la densité de dislocations est grande, plus la résistance augmente aux dépens d’une plus grande fragilité. Ce phénomène appelé écrouissage était bien connu des forgerons qui savaient que marteler un métal lui conférait une meilleure résistance. Alors qu’un écrouissage trop important est nuisible, on préfère trouver d’autres obstacles au passage des dislocations. Lorsque l’on ajoute en faible proportion du cuivre, du magnésium et du manganèse dans l’aluminium pur, on forme par trempe et recuit des précipités cristallins de taille micrométrique. Lors de leur mouvement, les dislocations qui se déplacent dans la matrice d’aluminium, se trouvent « épinglées » par ces précipités qui jouent alors un rôle durcissant. Les alliages ainsi obtenus, les Duralumins légers et résistants sont abondamment employés dans l’aéronautique. Dans le cas des aciers, ce sont les atomes de carbone qui servent d’obstacles aux dislocations.
Les métaux vieillissent-ils ?¶
Prenons l’exemple d’un rail. Outre le fait qu’il se corrode aux intempéries, il subit chaque jour la contrainte cyclique du passage des trains et les variations de températures entre le jour et la nuit, entre l’été et l’hiver. On dit qu’il est soumis à des cycles de fatigue. Même à faible charge, la contrainte maximale supportable, appelée limite d’endurance, est bien inférieure à la charge à laquelle les alliages se déforment plastiquement. C’est pourquoi, il n’existe en général pas de signe de dommage avant défaillance d’une pièce. Lorsque la fatigue se produit dans le domaine plastique, les contraintes résiduelles accumulées à chaque cycle conduisent généralement rapidement à la rupture au bout d’un faible nombre de cycles. Celle-ci se produit à cause de la présence de discontinuités géométriques en surface (effet d’entaille) et/ou des hétérogénéités microscopiques (comme par exemple les larges impuretés de graphite dans la fonte) qui sont propices à la formation et la propagation de fissures. Comme la fatigue est peu sensible à la fréquence charge/décharge, il est facile d’effectuer des tests accélérés sur des structures pour vérifier qu’elles supportent une sollicitation cyclique qui en service est beaucoup plus lente. Arrêter les fissures dans un matériau est extrêmement important. C’est pourquoi, on préférera utiliser des matériaux composites possédant des inclusions rigides permettant d’arrêter ou dévier les fissures.
Pourquoi le fer est-il aimanté ?¶
La propriété que possède certains métaux comme le fer, le cobalt et le nickel à présenter une aimantation spontanée est caractéristique des matériaux dits ferromagnétiques. L’explication de ce phénomène résulte de l’existence « d’aimants » individuels portées par les électrons (appelés spin). Dans la plupart des matériaux, les atomes ne portent pas de moment magnétique car leurs électrons se trouvent par paires avec des spins « pointant » dans des directions opposées, comme deux aiguilles de boussole en sens contraire. Par contre dans le cas où un ou plusieurs électrons sont célibataires, le moment magnétique porté par chaque atome n’est plus nul. Encore faut il que ces moments aient le bon goût de s’orienter correctement les uns vis-à-vis des autres pour qu’un moment magnétique global non nul soit observable. Dans le cuivre par exemple, ce n’est pas le cas car les moments magnétiques s’orientent de façon aléatoire les uns par rapport aux autres et aucune aimantation n’est ainsi observée : on parle de matériau paramagnétique. D’autres métaux possèdent au contraire un ordre magnétique résultant de l’interaction des moments atomiques. Dans les matériaux ferromagnétiques, ces moments tendent à s’orienter dans le même sens à l’intérieur de microdomaines. Comme ces domaines sont disposés aléatoirement les uns par rapport aux autres dans le cristal, là non plus, il n’existe pas d’aimantation macroscopique. Mais à la différence des matériaux paramagnétiques, il suffit d’appliquer un champ magnétique extérieur pour que les domaines bien orientés par rapport à ce champ croissent au détriment des autres et pour qu’alors le matériau devienne globalement aimanté. En supprimant le champ extérieur, une aimantation permanente demeure. C’est pourquoi, le fer est attiré par un aimant et qu’il demeure aimanté après avoir éloigné l’aimant. Pour supprimer, cette aimantation, il est nécessaire d’appliquer un champ magnétique opposé appelé champ coercitif. Les bons aimants sont donc ceux qui possèdent donc un champ coercitif grand, c’est à dire ceux pour lesquels il faut appliquer un champ magnétique important pour détruire leur aimantation. Aujourd’hui, les ferrites (des oxydes de fer), les alliages alnico (aluminium-nickel-cobalt) et à base de terres rares (cobalt-samarium) sont les principaux constituants des aimants.
Les métaux sont-ils bons pour la santé ?¶
Les métaux constituent près de 4% de notre poids et jouent un rôle indispensable dans le métabolisme. Pas d’hémoglobine sans fer, pas d’hormone thyroïdienne sans iode, pas d’os sans calcium (eh oui ! le calcium est un métal !). On y trouve ainsi principalement des métaux alcalins (sodium, potassium) et alcalino-terreux (magnésium, calcium) mais également en plus faible quantité (les oligo-éléments) du fer, du cuivre, du fluor… Cependant, les métaux dits lourds (plomb, mercure, cadmium) se révèlent particulièrement toxiques pour l’organisme même à faibles doses, car ils s’y fixent et s’y accumulent irréversiblement au cours du temps. Le cas du plomb est bien connu. La consommation régulière même en faible quantité de plomb transporté par l’eau de canalisations vétustes entraîne son accumulation principalement dans le cerveau et les os. Parce que les cellules cérébrales en cours de développement sont plus sensibles au plomb, les enfants sont particulièrement frappés par les maladies du plomb. Cela peut conduire à des retards mentaux irréversibles. Même si la lutte est engagée pour éradiquer les sources de pollution (limitation du plomb dans l’essence et dans l’eau de consommation, rénovation des logements insalubres possédant une tuyauterie et des peintures à base de plomb), cette intoxication insidieuse toucherait toujours environ 5% des adultes et 2% des enfants de 1 à 6 ans.
Quelles applications pour les alliages métalliques de demain ?¶
Le nombre infini de combinaisons possibles des métaux entre eux est une source inépuisable de problèmes et d’applications spécifiques potentielles. En aéronautiques tout d’abord, l’amélioration des performances des moteurs est rendue possible par l’emploi d’alliages à la fois plus légers et fonctionnant à plus hautes températures pour un meilleur rendement. Dans ces matériaux structurellement plus complexes, comme les futurs alliages niobium silicium, les propriétés mécaniques habituellement catastrophiques lorsque la température augmente reste dans leur cas raisonnables grâce à la présence d’une phase réfractaire résistante mais fragile dans une matrice beaucoup plus malléable pour assurer la mise en forme.
Les nombreux progrès techniques d’élaboration par électrodéposition (un procédé électrochimique qui consiste à recouvrir un métal (servant d’électrode) par une couche métallique dont l’épaisseur peut être contrôlée précisément) ou par mécanosynthèse (la mécanosynthèse consiste à broyer très finement des poudres métalliques. La nouvelle poudre nanométrique ainsi obtenue peut être compactée pour former un solide massif à grains nanométriques) permettent aujourd’hui d’obtenir des matériaux dont la taille des grains est de l’ordre du nanomètre. Parce que les dislocations ne peuvent pas ou difficilement se déplacer dans ces petits grains, ces nouveaux matériaux sont plus durs et peuvent alors servir comme revêtement résistant à l’abrasion.
Un grand nombre d’alliages (comme les Vitreloy des alliages de zirconium, titane cuivre, nickel et béryllium), obtenus par refroidissement extrêmement rapide de métaux en fusion sont dans l’impossibilité de cristalliser et ont une structure totalement désordonnée : ce sont les verres métalliques. Contrairement aux verres classiques à base de silicium, ils sont opaques et peu fragiles : ils sont même étonnamment élastiques de sorte qu’on les utilise déjà comme club de golf.
Stocker l’hydrogène nécessaire au fonctionnement des piles à combustibles sous une forme gazeuse à haute pression, c’est s’exposer à un sérieux risque d’explosion. De nombreux espoirs sont apparus récemment lorsqu’on a découvert que certains hydrures métalliques (comme les hydrures à base de magnésium ou les alanates NaAlH4) possédaient la capacité d’absorber l’hydrogène gazeux en grande quantité et de le restituer avec l’apport de chaleur, rapidement et sous faible pression.
Les alliages métalliques à mémoire de forme font partis d’une classe nouvelle de matériaux intelligents. Ces matériaux, comme par exemple le Nitinol ® à base de nickel et de titane, possèdent d’une part la capacité de pouvoir se déformer de façon importante et réversible (c’est l’effet superélastique) et d’autre part de retrouver leur forme initiale lorsqu’on les chauffe (c’est l’effet mémoire de forme). Supposons maintenant que l’on prenne un ressort en alliage à mémoire de forme, qu’on l’étire tout en effectuant un grand nombre de cycles thermiques pour l’habituer à cette nouvelle forme à haute température et qu’on le relâche pour qu’il reprenne sa forme initiale. Et bien le simple fait d’augmenter la température étirera de nouveau le ressort. Comme une température proche de celle du corps humain est suffisante, il est alors possible par exemple de déployer des valves à l’intérieure d’une artère sans chirurgie lourde.
Appendice: Questions en vrac¶
Ces questions m'ont été posé en reaction à l'article
Est-ce que conductivité électrique et thermique d'un matériaux vont toujours de pair ? Y a-t-il une constante qui permet d'obtenir l'une à partir de l'autre ?
La propagation de la chaleur et de l'électricité est liée intimement aux propriétés électroniques des solides même si on doit également considérer l'effet des vibrations des atomes. Il y a pourtant des exceptions comme le graphite ou le diamant, qui conduisent mal le courant mais bien la chaleur. C'est une propriété un peu spéciale de leur structure électronique qui se situe à la frontière conducteur/isolant. Pour cette raison on ne les place pas vraiment dans la catégorie des métaux. De même les semi-conducteurs ont une conductivité électrique qui augmente avec la température (contrairement d'ailleurs aux conducteurs normaux). C'est tout simplement parce qu'apporter de l'énergie sous forme de chaleur permet aux électrons de sauter de proche en proche (ce qui n'est pas nécessaire pour les conducteurs ordinaires, au contraire le mouvement plus désordonné des électrons quand la température augmente rend moins efficace la conduction, un peu comme si il y avait des voitures roulant à contre sens sur l'autoroute, ça ralentit le traffic, non ?). Dans le cas général, il existe donc bien une relation liant la conductivité thermique et electrique appelée relation de Wiedemann et Franz.
Il est important de rajouter ici que les propriétés de transport dans un solide sont avant tout dues à leur structure et pas uniquement au caratère individuel des atomes le constituant: certains alliages métalliques sont de très mauvais conducteurs thermique et electronique. Les quasi-cristaux en sont des exemples: ils sont formés d'amas d'atomes dans lesquels les électrons peuvent se déplacer facilement par contre il leur est difficile de sauter d'un amas à l'autre.
Les impuretés et les dislocations dans un métal peuvent influencer également les propriétés conductrice d'un métal. Ils agissent comme des pièges pour les électrons (un métal pur non déformé sera un meilleur conducteur). C'est pourquoi la maîtrise des défauts dans les semi-conducteurs est un défit important pour ce qui est de leurs propriétés électroniques. Mais du fait que les composants électroniques (les transistors par exemple) sont soumis à des cycles de chauffage (fonctionnement/arrêt...), des contraintes se developpent et des dislocations apparaissent ce qui fait changer inévitablement les proprietés de conduction: c'est pour ça que nos ordinateurs vieillissent !
Concernant les miroirs, on dit que les électrons absorbent et réémettent les photons... Mais pourquoi toujours dans une direction symétrique par rapport au rayon incident ? Et comment l'électron sait quel est le plan du miroir par rapport auquel il doit faire cette symétrie ?
Pour comprendre ce phénomène, il faut penser la lumière en tant qu'onde et non comme particule. La façon dont les ondes lumineuses sont transmises ou réfléchies lorsqu'on change de milieu obéit en particulier à la célèbre loi de Snell-Descartes.
On peut imaginer schématiquement une onde comme une vague sur l'eau. L'onde forme des cercles concentriques émanant d'une source. Elle se déplace à une certaine vitesse (qui est liée à la rigidité du milieu) et forme ce qu'on appelle un front d'onde (c'est l'endroit où l'on a des points d'égale amplitude): on dit que l'onde est sphérique. Lorsqu'on se trouve sur le rivage loin de la source, on voit arriver des fronts d'onde rectilignes: on parle d'onde plane. Pour la lumière ça marche à peu près pareil (ce qui vibre c'est un champ électrique et magnétique, et la rigidité c'est l'indice du milieu). Au 17-18ème siècle, on se posait la question de savoir comment une onde pouvait se propager. Huygens a alors eu l'idée de dire, prenons une onde sphérique et disons qu'à chaque nouveau point de l'espace qu'elle rencontre, une nouvelle onde sphérique est réémise (voir l'image ci dessous). Ca marche aussi pour les ondes planes. Cela permet d'expliquer un bon nombre de phénomènes optiques comme les interférences, la réflexion et la refraction.
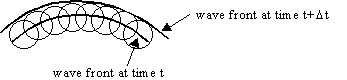
Imaginons maintenant un front d'onde plan arrivant sur notre miroir en biais. En rencontrant la surface, on va réémettre autant d'ondes sphériques qu'il y a de points sur notre surface. Les ondes réfléchies forment alors un nouveau front d'onde qui forme un angle égal avec la surface que le front incident. C'est bien ce qui se passe sur une surface bien polie: les atomes absorbent et réémettent l'onde incidente de cette manière. Et le fait que ça soit bien poli est capital sinon vous ne diffusez pas de telle manière que votre front d'onde soit réfléchi dans la bonne direction. Pour la lumière visible il ne faut pas de défaut de l'ordre de la longueur d'onde soit moins de 0.1micron ! Pour le rayon réfracté l'explication reste valable, si on considère que les ondes sphériques se propageant dans un milieu d'indice plus grand. Dans ce cas, comme il y a absorption et émission sans arrêt entre les atomes, le front d'onde progresse moins vite, ce qui explique que l'angle de réfraction soit différent.
Un miroir ne reflète alors que les longueurs d'onde correspondantes aux différences d'énergie entre les couches d'électrons du matériaux réfléchissant ? Un miroir a des raies de reflexion ? Un miroir à l'aluminium et à l'étain ne reflètent pas la même chose ?
Oui et c'est pour ça que les objets sont colorés de façon habituelle, mais pour un métal c'est un peu différent. la structure électronique d'un métal est telle qu'un électron peut absorber à peu près toutes les fréquences et les réémettre. C'est un bon absorbeur car ces états d'énergies sont très proches les uns des autres et forment presque un continuum. Il n'y a donc pas de miroir à raie.
Il semble qu'il y ait une relation entre le fait qu'un matériau soit transparent et le fait qu'il soit mauvais conducteur électrique. Est-ce toujours le cas ? A contrario, un matériau conducteur est-il forcément opaque ?
Non et pour preuve, les verres métalliques ! ils sont opaques et ont une structure dite amorphe (c'est à dire sans organisation apparente). Ils sont aussi mauvais conducteur que leur homologue transparent appelé verre qui est un fait un verre de silice. Toutefois cette remarque est plutôt assez vraie: les matériaux transparents auxquels on fait allusion ici sont les minéraux, qui ne sont pas à proprement parler des métaux mais le plus souvent des oxydes, des hydroxydes ou des sulfures cristallisés, et ne possèdent pas vraiment de liaison métallique et pour cette raison ne sont pas de bons conducteurs.
Un métal immobile ne fatigue-t-il pas aussi (exemple type de l'étagère qui fléchit, alors qu'il n'y a pas de mouvement) ? Est-ce juste le temps (changement de température, de pression atmosphérique, etc.) qui le fait travailler, donc fatiguer ?
Oui votre étagère fatigue aussi sous son propre poids. C'est ce que l'on appelle le fluage. Pour exemple, le toit de la cathédral de Washington fabriqué avec un plomb très pur (et donc mou) se mettait à couler sous son propre poids avec le temps... tout ca pour imiter les cathédrales anglaises qui etaient fabriquées elles avec un plomb plus impur et donc moins coulant.
Pour en savoir plus¶
-
L’aluminium un si léger métal, Ivan Ginberg, découvertes Gallimard.
-
Mécanique des milieux continus, introduction à la plasticité, Joël Douin, Diderot, 1997.
-
Un site construit d’après l’exposition sur l’aluminium à la cité des sciences 1
-
La revue Alliage n°53-54 : Métallurgie, Art, Informatique, Pablo Jensen, p. 35.